关键词:伊立替康,Onivyde,脂质体,主动载药,蔗糖八硫酸酯钾
一、 伊立替康脂质体Onivyde的发展历程
伊立替康,又名CPT-11、开普拓等,属于喜树碱衍生物,拓扑异构酶I抑制剂,是国际抗癌药物市场上一大类主导产品,目前广泛应用于结肠癌等肿瘤疾病的治疗,对氟尿嘧啶耐药病例仍有效。目前该药已在全球100多个国家上市,临床上广泛应用于转移性结直肠癌、小细胞肺癌的一/二线、胰腺癌的一/二线治疗,2001年在国内上市。
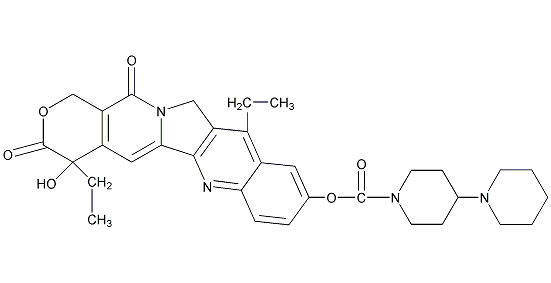
图1 伊立替康结构式
伊立替康能在羧酸酯酶作用下转化成具有100-1000倍更高活性的代谢物SN-38。SN-38不可被P-糖蛋白识别,因此伊立替康可能在对其它标准化学疗法具有抗性的肿瘤上具有活性。
最初投入市场的制剂类型是盐酸伊立替康注射液,但在实际使用的过程中,该剂型逐渐暴露出一个问题:伊立替康的内酯环结构易水解,在pH>6条件下平衡快速向羧酸盐型方向转化。羧酸盐型的伊立替康药理活性低,毒性更强。生理条件(pH 7.4)下,由于血清蛋白优先与羧酸盐络合而使平衡偏向活性低的羧酸型,造成有效的内酯型比例过低,达到平衡时,“低效高毒”的羧酸盐形式化合物所占比重高达90%。因此,研制一种提高内酯型稳定性的伊立替康制剂的需求愈发迫切。
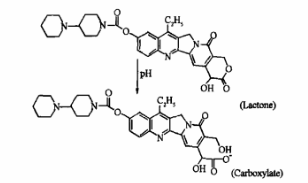
图2 伊立替康内酯型→伊立替康羧酸型的转化过程
于是,研发者们将目光投向了新型药物递送系统——脂质体,经过十多年研发,终于成功研制出伊立替康脂质体Onivyde,并由此引出了一段波折起伏的故事。
2003年2月,台湾智擎生技制药(PharmaEngine)创立,其总经理叶常菁博士慧眼识珠,以300万美金的价格从美国Hermes Biosci公司购得PEP02(MM-398,Onivyde前身)的开发权利,带领二十多名员工潜心研发十多年。
2012年,该项目在台湾以外的市场及开发等全部活动权以约2.2亿美元的价格授权给美国Merrimack公司。从300万到2.2亿,仅用了9年时间。
2014年Merrimack公司又将该项目除美国和台湾之外的所有权以约10亿美元的价格售予美国Baxter(百特)。其后,Baxter开始进行该项目在其它国家及地区的新药申请并将美国以外市场授权Shire(夏尔)。
2015年,Onivyde通过美国FDA新药上市核准,联合5-氟尿嘧啶和甲酰四氢叶酸(5-FU/LV),用于治疗既往接受吉西他滨为基础的化疗药物治疗病情进展的胰腺转移性腺癌患者。
2016年10月,Onivyde获得欧洲EMA新药上市核准。
2017年,Onivyde获得韩国及新加坡药证核准。
2017年,Merrimack再次出售该项目,将其美国的商业化权力和制备生产线以最高10.25亿美元的总价售予IPSEN。
2018年,Shire将旗下肿瘤学业务以24亿美元打包出售给Servier(施维雅),其中包括Onivyde。
2020年6月日本批准Onivyde上市,用于治疗化疗后无法切除的胰腺癌。
自此,Onivyde出售史暂时告一段落,目前由三家公司持有,分别是台湾智擎(台湾地区)、Servier公司(欧亚区)及IPSEN公司(美洲区)。
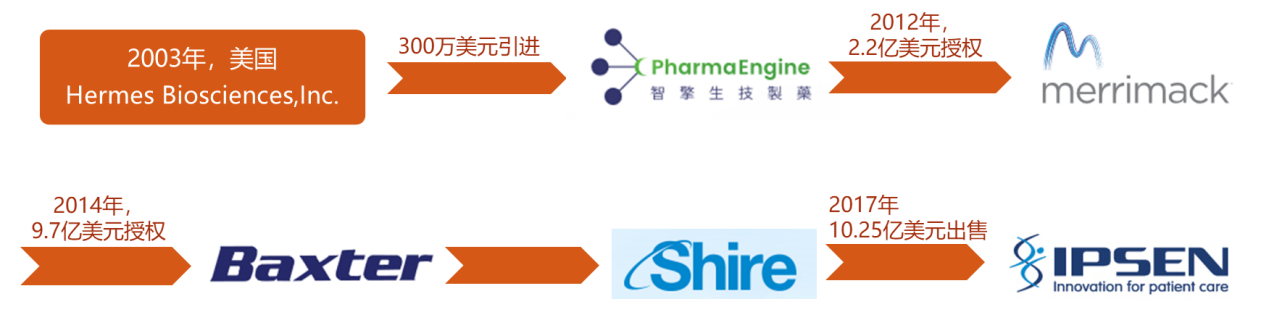
图3 Onivyde授权/转让历程示意图
Onivyde仅用十余年就从300万美元的技术包发展到10亿、24亿美元的大项目,但业界均认为这是划算的买卖,因为其瞄准的是“癌王”胰腺癌,此外相关公司也在积极开发其他适应症,包括胃癌,肺癌,结直肠癌等。

图4 Onivyde其他适应症及对应开发阶段
胰腺癌的治疗一直是以吉西他滨为基础的化疗为主,对于复发或转移性的没有好的治疗方案。Onivyde是全球第一个,也是目前唯一核准使用在曾接受一线标准治疗药物吉西他滨失败后的晚期转移性胰腺癌的新药。是近年来唯一获批的二线治疗用药。
目前Onivyde在美国售价为每针2,590美元左右,每二周打一次,平均全年药费约为11.7万美元,仅IPSEN公司(美洲区)2019年该药品销售额已达1.35亿欧元,2020年为1.23亿欧元。此外,考虑到Onivyde有多个适应症(大肠直肠癌、胃癌、小细胞肺癌等)已进入临床二/三期试验,可以预期未来其销售额及市场价值必呈上涨趋势。
二、 伊立替康脂质体在国内的现状及前景
Onivyde的仿制存在几个突出优势:①技术壁垒小,仿制难度低;②工艺与阿霉素脂质体相似;③处方及大致工艺已知;④市场规模及利润极具潜力;⑤原研**即将到期。接下来笔者将对其中几点进行具体分析。
从生产工艺的角度,伊立替康脂质体的制备技术采用的是梯度主动包封法,工艺过程分为乳化、挤压整粒、超滤除醇/置换体系、药物包封和过滤除菌等。这种生产工艺和已上市的盐酸多柔比星脂质体等主动载药的品种类似,基本可以对现有已成熟的开发流程和生产放大工艺进行复制,具有较强的技术可行性。
从注册审评的角度,药审机构对脂质体等特殊制剂的审评较为审慎,对一致性评价及报批工艺的可放大性要求较高。所以在申报时需要有充分的一致性评价数据(CMC&Preclinical),同时申报的工艺应相对成熟。
从原研**的角度,Onivyde在美国的**于2025年到期,该**也进入了中国。根据目前的药物注册管理办法,现在已经可以着手进行该药物的注册申报,待完成临床、审评及生产准备后,预计可在**到期时获批上市。
从竞争对手的角度,国内目前有普通伊立替康在售,同时伊立替康脂质体也有申报,但大部分厂家都是在Onivyde上市之前按照5类申报的(截止2021年11月底总计申报22个,其中报临床20个,新药申报16个,仿制申报仅1个),和国外已上市的品种有一定差异。由于不符合仿制药的技术要求,此类申报要么重新递交资料变更类别,要么继续按照改良型新药申报,这两个选择都会一定程度上抵消先行申报的时间优势。
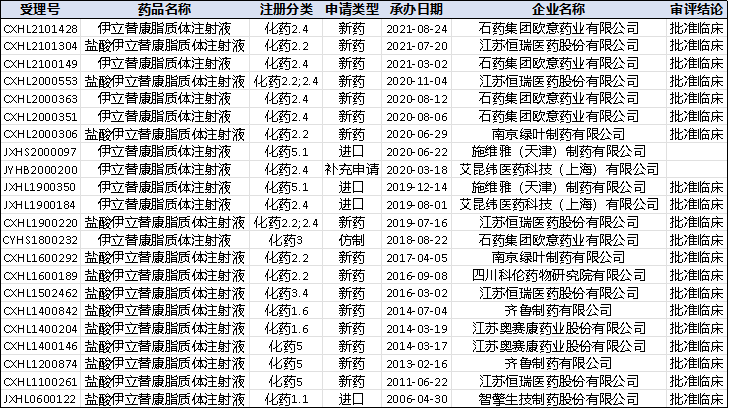
图5-1国内伊立替康脂质体药品注册与受理情况(截止2021.11,数据来源:药智网)

图5-2国内伊立替康脂质体临床试验情况(截止2021.11,数据来源:药智网)
由于最近的药政改革,未来预计还会有更多厂家进入特殊制剂领域,类似于Onivyde这种品种较新,市场潜力巨大的项目,成为各厂家竞相仿制热点的势头已初露端倪。而基于上述分析,相关企业入场的时间窗口仍然存在。未来国内首仿花落谁家?会给国内医药领域带来怎样的变数?我们还需拭目以待。
三、 伊立替康脂质体处方简析
了解过伊立替康脂质体的发展历程与市场情况,它本身的处方工艺等方面又有哪些值得关注的点呢?根据EMA网站Onivyde的公共评估报告(《onivyde-epar-public-assessment-report_en》)以及易普森公司的**文件内容(申请公布号CN 108366965 A),笔者对伊立替康脂质体的处方、成分、成品、实施方式和实施例等方面的信息进行了整理及归纳。
1.简介
伊利替康脂质体成品是含5mg/ml三水合伊立替康(伊立替康蔗糖盐)活性物质的输注溶液的浓缩物,活性物质包裹在脂质体中。
其他成分包括:
(1)以脂质体形式存在的脂质:
DSPC(1,2-二硬脂酰-SN-甘油-3-磷酸胆碱,CDE登记号:F20180000837;DMF备案号:6252;AVT货号:S01005);
胆固醇(CDE登记号:F20170000106;DMF备案号:024780;AVT货号:001001);
DSPE-MPEG2000(N-(羰基甲氧基聚乙二醇2000)-1,2-二硬脂酰-SN-甘油-3-磷酸乙醇胺钠盐,CDE登记号:F20170000595;AVT货号:F01008)
(2)其他辅料:
蔗糖八硫酸酯盐(CDE登记号:F20210000349;AVT货号:011001,药用注射级别,GMP生产,大量现货供应)
HEPES缓冲液,氯化钠和注射用水。
2.活性物质
盐酸伊立替康三水合物,分子式为C33H38N4O6•HCl•3H2O。它的相对分子质量为677.18,结构如下:
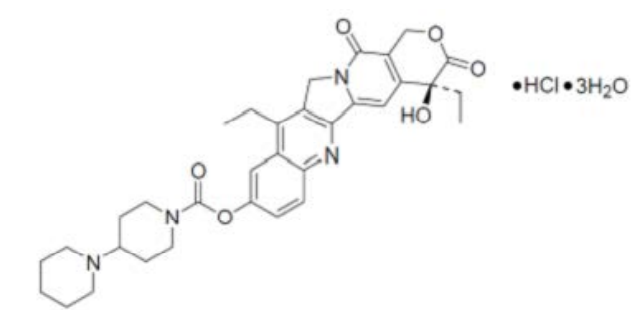
图6 三水合盐酸伊立替康结构式
活性物质为淡黄色至黄色结晶粉末,具有吸湿性和光敏性,在DMSO和无水乙酸中自由溶解,在乙醇中微溶,在pH为4的缓冲液中少量溶解,在pH为2的缓冲液中微溶。由于手性中心的存在,伊立替康表现出立体异构性。立体异构的来源是原材料喜树碱。经研究证明,单晶形式的三水合盐酸伊立替康是可以稳定生产的。其多态性与成品的性能无关,因为活性物质在成品制造过程中会溶解。
活性物质的技术参数包括以下检验项目: 外观、分析(HPLC)、鉴别(IR、HPLC)、手性纯度(UV、HPLC)、氯化物鉴定(pH Eur.)、杂质(HPLC)、残留溶剂(pH Eur.)、水含量(KF)、重金属(pH Eur.)、溶解度(pH Eur.)、着火残留(pH Eur.)、微生物限度(pH Eur.)、细菌内毒素(pH Eur.)。
由于其作用机制,伊立替康具有潜在的遗传毒性和致癌性。不能排除原料、合成或降解过程中产生的中间体杂质的致突变和致癌潜力。与ICH M7一致,在这些情况下,暴露于诱变杂质不会显著增加活性物质的致癌风险。因此,活性物质中的这些杂质被控制在非诱变杂质的可接受水平,符合ICH Q3A指南中描述的鉴别(0.10%)和确认阈值(0.15%)。
稳定性结果表明,活性物质具有吸湿性且对光敏感,在避光和防潮的情况下是足够稳定的。在没有特殊储存条件的情况下储存于符合规定的容器中时,建议的复验期为3年。
3.成品药物
(1)产品和药物开发的描述
成品为白色至微黄色不透明的无菌浓缩液,用于注射。它由含有盐酸伊立替康三水合物的脂质体等渗分散体组成。
脂质体是直径约110nm的单层磷脂双分子层小泡,磷脂双分子层包绕一个内水相,其中含有凝胶或沉淀状态的蔗糖盐形式的伊立替康。脂膜由DSPC、胆固醇和MPEG-2000-DSPE组成。脂质体分散在水缓冲溶液中。
根据原研**,当通过喜树碱化合物(如伊立替康)与包封多硫酸酯化阴离子捕获剂(如蔗糖八硫酸酯)的脂质体反应制备载药脂质体时,所得载药脂质体的稳定性取决于捕获剂-脂质体中硫酸酯基团的初始浓度和脂质体中包封的喜树碱与磷脂的比率。
在优选的实施方式中,伊立替康脂质体由DSPC、胆固醇和MPEG-2000-DSPE以3:2:0.015摩尔比组合的混合物制成。脂质体制剂包括1,2-二硬脂酰-sn-甘油-3-磷酸胆碱(DSPC)的浓度为约6.81mg/mL、胆固醇的浓度为约2.22mg/mL、甲氧基封端的聚乙二醇(MW 2000)-二硬脂酰磷脂酰乙醇胺(MPEG-2000-DSPE)的浓度为约0.12mg/mL。
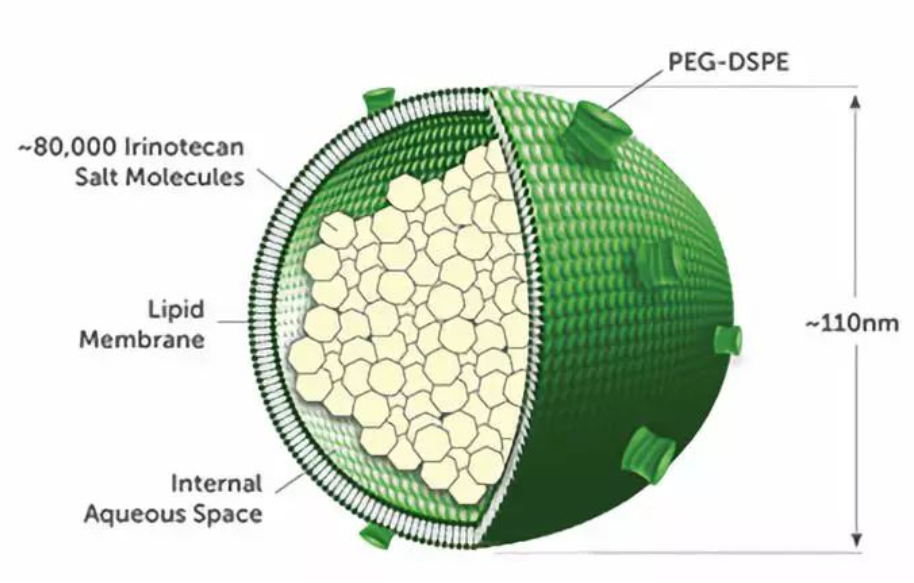
图7 伊立替康脂质体示意图
三水合物盐酸伊立替康以伊立替康蔗糖盐的形式存在于脂质体中。
脂膜由DSPC、胆固醇和MPEG-2000-DSPE组成。脂质体辅料的功能是产生脂质体双层膜,形成包裹着活性物质的单层囊泡,直到被输送到目标部位(如肿瘤组织)。选择脂质体辅料是由于它们的特性,当它们结合在一起时,产生的脂质体能够主动负载和保留活性物质,同时降低脂质体在人体内的蛋白结合水平,从而延长其在体内的循环时间。
DSPC是脂质体双分子层的主要脂质成分((优选占所有脂质成分总重量的74.4%),基于其高纯度而选择。它是一种合成脂类,由明确的脂肪酸组成,具有相对较高的相转变温度(Tm为55°C),并以高度有序的凝胶相结构存在,在生理温度(37°C)下抵抗小分子药物的渗透性。
胆固醇是脂质体双分子层的另一个主要成分(优选占所有脂质成分总重量的约24.3%)。它被用于稳定脂质体磷脂膜免受血浆蛋白的破坏,减少血浆调理素与脂质体的结合,而后者负责将脂质体从血液循环中快速清除。此外,胆固醇与磷脂双分子层结合,可以降低溶质/药物的渗透性。
MPEG-2000-DSPE是脂质体双分子层的一个微量组分(优选占所有脂质成分总重量的约1.3%)。它在脂质体表面提供一个极小的空间屏障,防止脂质体聚集。MPEG-2000-DSPE包被的脂质体在大小和药物包封方面表现稳定,通过平均分子量和多分散性指数等技术参数进行衡量。
脂质体分散在由HEPES缓冲液、氯化钠和注射用水组成的缓冲水溶液中。
在成品生产过程的初始阶段,盐酸伊立替康三水合物活性物质溶解在葡萄糖溶液中。随后将其与脂质体混合,通过主动载药方式,沉淀并在脂质体中封装为伊立替康八硫酸蔗糖盐。盐酸盐反离子被蔗糖酸盐取代,在脂质体内形成伊立替康蔗糖酸盐。蔗糖酸盐与活性物质包封在脂质体中。
成品药物的关键质量参数为:外观、伊立替康鉴定、脂质鉴定、胆固醇鉴定、伊立替康浓度、药物包封百分比、伊立替康杂质、脂质杂质、残留溶剂、细菌内毒素、生物负荷及无菌性、药物与磷脂比、磷脂与胆固醇比、容器内可提取体积、体外释放、渗透压、粒径、粒径分布、注射颗粒物、pH值、ζ电位。
本产品采用无菌过滤和无菌灌装生产。由于成品是脂膜相变温度为55℃的脂质体,无法像普通水相产品一样通过高温进行末端灭菌,灭菌方法因此得到适当的调整。
(2)蔗糖八硫酸酯盐载药方法的创新应用
在药物开发过程中,筛选了许多不同剂型的阴离子药物包封液。研究发现蔗糖八硫酸盐是一种较好的阴离子药物包埋溶液。 蔗糖八硫酸酯盐(sucrose octasulphate)加入到成品生产过程中,通过反应生成三乙铵蔗糖八硫酸盐(triethylammonium sucrose octasulphate,TEA-SOS)。与其他剂型相比,该剂型维持了包封率,且伊立替康在脂质体中的保留率较高。
蔗糖八硫酸酯钾(K-SOS)【CDE登记号:F20210000349;AVT货号:011001,药用注射级别,GMP生产,大批量现货供应】是一种新型辅料,以它为原料,制备了用于脂质体载药的三乙铵蔗糖八硫酸酯盐(TEA-SOS)。蔗糖八硫酸酯盐通过离子交换转化为TEA-SOS。TEA-SOS与脂质经聚碳酸酯膜挤压被动包裹形成脂质体。随后,通过过滤除去脂质体外部的TEA-SOS,形成跨脂质体脂膜的电化学梯度。
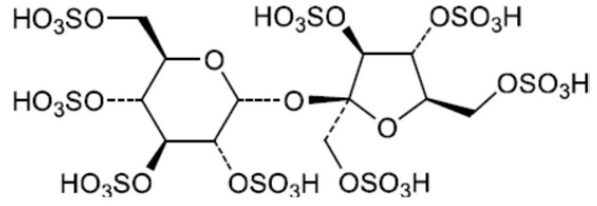
图8 蔗糖八硫酸酯结构式
(3)产品制造和过程控制
制造过程包括五个主要步骤: 脂质体形成(包括脂溶出、多层囊泡(MLV)形成、单层小囊泡(SUV)形成及定型)、主动载药(渗滤、载药)、原料药制剂配制、灌装完成(包括减少微生物污染水平、无菌过滤)、标签及包装。 该工艺被认为是一种非标准制造工艺。已经证明,该制造工艺能够以可重复的方式生产出质量符合预期的成品。过程中控制对于这种类型的生产工艺和制药形式是足够的。
(4)外源因子
该产品使用从羊毛中提取的胆固醇,供应商提供了有效TSE证明。产品中没有使用其他来自动物或人类的辅料。
(5)实施方式
根据原研**文件,整理部分实施方式如下:
实施方式1:
储存稳定的脂质体伊立替康组合物,其具有7.00~7.50的pH并且包含包封伊立替康蔗糖八硫酸酯的伊立替康脂质体在囊泡中的分散体,所述囊泡由胆固醇和DSPC和MPEG-2000-DSPE组成,所述脂质体伊立替康组合物包含伊立替康部分的浓度等同于,以伊立替康游离无水碱的克数计,500mg(±10%)伊立替康部分每mmol总脂质体磷脂和4.3mg伊立替康部分每mL所述脂质体伊立替康组合物,所述储存稳定的脂质体伊立替康组合物在4℃储存的前6个月期间稳定化以形成小于20mol%溶血-PC。
实施方式2:
储存稳定的脂质体伊立替康组合物在4℃储存的前6个月期间稳定化以形成小于20mol%溶血-PC,脂质体伊立替康组合物通过方法制备,所述方法包括以下步骤:
(a) 形成脂质在TEA8SOS硫酸酯浓度为约0.45M的溶液中的分散体,所述溶液的pH为约6,所述分散体中的脂质分别为约3:2:0.015摩尔比的DSPC、胆固醇和MPEG-2000-DSPE;
(b)将60-70℃的脂质分散体挤出穿过至少一个0.1μm膜以形成脂质体;(c)除去在所述脂质体外部的源自TEA8SOS的离子;
(d)将在60-70℃温度的脂质体与使用伊立替康游离碱或伊立替康盐制备的溶液接触,由此形成包封伊立替康的脂质体的制剂;
(e)除去在所述脂质体外部的源自TEA8SOS和依立替康成分的物质;
(f)将所述组合物的pH调节为7.3。实施方式3:
前述实施方式任一项的脂质体伊立替康组合物,其具有的总伊立替康部分含量等同于4.3mg/ml伊立替康无水游离碱。实施方式4:
前述实施方式任一项的脂质体伊立替康组合物,其中包封在所述脂质体中的所述伊立替康作为蔗糖八硫酸酯盐呈凝胶状态或沉淀状态。
(6)实施例
基于原研**文件,整理实施例如下:
首先,将形成脂质体的脂质溶解于加热的乙醇中。这些脂质包括DSPC、胆固醇和MPEG-2000-DSPE,摩尔比为3:2:0.015。所得乙醇-脂质组合物分散于包含取代铵和聚阴离子的含水介质中。脂质体分散体可以例如如下形成:在大于脂质转变温度的温度(例如60-70℃),将乙醇脂质溶液与包含取代铵离子和聚阴离子的水溶液混合,然后在压力下将所得脂质悬浮液(多层脂质体)挤出穿过一个或多个聚碳酸酯膜过滤器,所述膜过滤器具有限定的孔径,例如50nm、80nm、100nm或200nm。优选取代铵为质子化三乙胺(TEA),聚阴离子为蔗糖八硫酸酯(SOS),优选以化学计量比组合(例如TEA8SOS)。TEA8SOS的浓度可以基于伊立替康加载到脂质体中的量进行选择(例如完全耗尽脂质体上的浓度加载梯度,和/或提供包含约1:8摩尔比的SOS和伊立替康的脂质体)。然后除去所有非截留TEA或SOS(通过凝胶过滤,渗析或超滤/渗滤等)。
然后,在可以有效将伊立替康加载到捕获剂脂质体中的条件下(即,在允许伊立替康进入脂质体中以与离开脂质体的TEA交换的条件下),将所得捕获剂脂质体(例如包封取代铵化合物,例如TEA8SOS)与伊立替康溶液接触。加载伊立替康的溶液(例如15毫克/毫升的无水伊立替康-HCl,其可以使用相应量的伊立替康-HCl三水合物制备)优选包含渗透剂(例如5%葡萄糖)和pH为6.5。主动载药通过增加组合物的温度高于脂质体脂质的转变温度(例如增至60-70℃)以加速取代铵化合物(例如TEA)和伊立替康的跨膜交换来促进。在一些实施方式中,伊立替康蔗糖八硫酸酯在脂质体中呈凝胶状态或沉淀状态。优选继续通过脂质体与取代铵化合物(例如TEA)跨膜交换来加载伊立替康,直到全部取代铵化合物(例如TEA)从脂质体中除去,从而耗尽所有跨膜脂质体的浓度梯度。
可以除去脂质体外伊立替康和取代铵化合物(例如TEA)以得到最终伊立替康脂质体产品。这种除去可以通过各种方法促进,包括凝胶(尺寸排阻)色谱法、渗析法、离子交换法和超滤/渗滤法。脂质体外部介质替换为可注射的药用流体,例如缓冲(优选pH为7.2至7.3)等渗盐水。最后,脂质体组合物进行灭菌,例如通过0.2微米过滤,将其分配到单剂量小瓶中,标记和储存,例如在2-8℃冷藏,直至使用。在除去剩余脂质体外伊立替康和铵/取代铵离子(例如TEA)的同时,脂质体外部介质可以用药用流体替代。
四、 讨论
关于伊立替康脂质体,笔者希望从以下几个方面进行讨论:伊立替康脂质体药物研发的要点;脂质体药物递送系统;蔗糖八硫酸酯钾对比硫酸铵两种主动载药方式的优劣。
(1)伊立替康脂质体研发要点
伊立替康脂质体研发工作聚焦于以下几点:①选择一种最理想的反荷离子(counter ion)用于主动载药;②确定一个脂质膜组分中DSPC与胆固醇的最佳比例,该比例影响脂质膜的物化性质以及将活性物质保留在脂质体内部的能力;③脂质膜组分MPEG-2000-DSPE的选择,该组分存在于脂质膜表面,提供了一个空间位阻,从而避免脂质体聚集;④选择适当的缓冲液,能够为注射用浓缩液保持最佳pH范围。
(2)脂质体药物递送系统
脂质体(liposome)是一种由单个双分子层(单层)和/或一系列同心双分子层(多层)组成的球状微囊,用于包裹营养物质或原料药,大小通常为纳米到微米级。脂质体的主要组成材料是磷脂和胆固醇。磷脂是脂质体的主要成膜材料,常用的磷脂有卵磷脂、磷脂酰胆碱、大豆磷脂、磷脂酰乙醇胺等。
当脂质体用于药物递送时,药物通常包封在脂质体内部,一般而言水溶性药物包封在水性隔室中,亲脂性药物则包封在脂质双分子层中。脂质体作为药物递送系统有如下优势:
①被动靶向:脂质体被体内巨噬细胞吞噬,形成肝,脾等网状内皮系统的被动靶向性。
②缓释作用:脂质体包裹的药物,减少了肾排泄和代谢,形成一个缓慢释放的过程。
③降低药物毒性:被动靶向作用使得药物容易集中于部分器官,可明显降低药物毒性。
④提高稳定性:不稳定药物能被磷脂膜保护,并通过调节内水相pH、离子浓度等条件,可有针对性地提升目标药物的稳定性。
目前脂质体作为药物递送系统已得到了广泛应用,如抗肿瘤药物(注射用紫杉醇脂质体(南京绿叶制药),注射用盐酸多柔比星脂质体(Doxil),注射用柔红霉素脂质体(DaunoXome));
抗真菌药物(注射两性霉素B脂质体(Amphotec));疫苗(甲肝疫苗(Epaxal)、流感疫苗(Inflexal V))等。
此外,长循环脂质体、主动靶向脂质体和递送生物分子的阳离子脂质体已经相继问世,基于这些成果,脂质体药物己愈来愈受到重视并得到广泛应用。
对伊立替康而言,其最初上市的剂型为普通注射剂,但存在严重的不良反应,在临床应用上存在一定的局限性。采用脂质体作为伊立替康给药载体,可避免生理条件下伊立替康大量转变为羧酸盐形式,显著提高药效,同时增加药物向肿瘤部位的转运,降低不良反应。
(3)蔗糖八硫酸酯三乙胺对比硫酸铵:两种主动载药方式的比较
脂质体常用制备方法主要有薄膜分散法、逆相蒸发法、注入法、超声波分散法等。在制备含药脂质体时,根据药物被装载的机理不同,又可分为被动载药法与主动载药法两大类。
传统上采用较多的是被动载药法,即首先将药物溶于水相或有机相,然后用适宜方式制备含药脂质体。但该方法仅适用于脂溶性或水溶性强的药物,而对于两亲性药物,如某些弱酸弱碱,其油水分配系数受介质pH和离子强度的影响较大,用被动载药法制得的脂质体包封率低。
主动载药法,即通过内外水相的不同离子或化合物梯度进行载药,对两亲性药物脂质体的包封率高、渗漏少。盐酸伊立替康作为两亲弱碱性药物,其水溶性较好,采用主动载药法可获得较高的包封率。
美国FDA于2015年10月批准上市的盐酸伊立替康脂质体注射液,采用的主动载药方法是蔗糖八硫酸酯三乙胺(TEA8SOS)梯度法。中国药科大学的吴刚等对这两种主动载药方式进行了研究与对比。
载药量方面,两种方法的载药量分别为32.0%、25.8%,蔗糖八硫酸酯法略胜一筹。
释药方面,在PBS中的释放结果表明,两种主动载药法制备的盐酸伊立替康脂质体的释药速率存在明显差别(24h时硫酸铵梯度法制备的伊立替康脂质体释药比例已达90%,而蔗糖八硫酸酯法对应的释药比例仅约40%)。由于蔗糖八硫酸酯和盐酸伊立替康可以在内水相中形成沉淀,因此提高了盐酸伊立替康在脂质体中的滞留效果,使药物释放速率明显减慢。
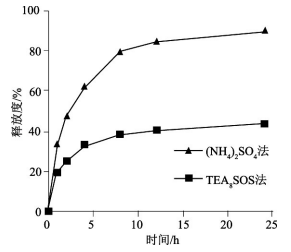
图8 两种主动载药方式制备的盐酸伊立替康脂质体的体外释放曲线(n=3)
如上文所述,由于伊立替康的内酯环结构在中性及碱性溶液中不稳定,从脂质体中释放出的药物在生理条件下容易水解成没有活性且毒性更高的开环产物从而降低药效,因此与硫酸铵梯度法相比,以蔗糖八硫酸酯三乙胺梯度法主动载药的伊立替康脂质体可以更好地保持药物活性。
五、 回顾与展望
伊立替康是喜树碱的半合成衍生物,早在1960年研发人员就发现了喜树碱的抗肿瘤特性,1980年发现了它与拓扑异构酶I的相互作用机理,后来经过对喜树碱的进一步研究,分别于1994年和1996年研制出了两种新型水溶性喜树碱类衍生物:伊立替康(irinotecan)和拓扑替康(topotecan),然而由于伊立替康在生理条件下(pH7.4)会大量水解成没有活性且毒性更高的开环产物导致严重的不良反应,导致其在临床应用上一直存在较大的局限性。
好在,快速发展的医药科技为这一困局带来了曙光。长循环脂质体等新兴药物递送技术的使用,蔗糖八硫酸酯三乙胺梯度法等新型主动载药方法的建立,以及蔗糖八硫酸酯盐、DSPE-MPEG2000、海藻糖等新型药用辅料的出现,这些因素在研发人员十余年甚至数十年的坚持与探索下,统合到一起,帮助伊立替康这一“古老”的化合物再次焕发出生机。
在国家越来越重视医药创新的当下,这些不断涌现的新技术,是否是国内医药企业弯道超车的一个机会?在新药物新靶点等领域竞争已然白热化的当下,我们是否可以分出一些精力,去回顾一些看上去不够“新”的东西?
比如脂质体,当大部分人的目光聚焦于它用于mRNA疫苗的递送时,是否有一些生产使用多年、早已习以为常的药物,可以在它的帮助下或提高药效,或减少不良反应,或增加新的适应症?
再比如蔗糖八硫酸酯盐,它可以用来提高伊立替康脂质体的主动载药效果,延长释药时间,那么用于类似伊立替康的化合物的主动载药,是不是也有可能起到一定的效果?
用新的技术,把老的产品再做一遍。这听起来或许不够新,不够酷。但只要足够实用,只要能帮到广大患者,在笔者看来,就是一件值得去做的事。
关于脂质体,蔗糖八硫酸酯盐等技术的应用创新,您又有哪些想法或观点呢?欢迎在评论区留言,如果被精选,我们将与您联系并寄出精美礼物一份,欢迎共同探讨~

参考资料:
1. Onivyde**文件(申请公布号CN 108366965 A)
2. EMA,onivyde-epar-public-assessment-report_en
3. 吴刚、周玉洁、魏悦蕾等,两种主动载药的伊立替康脂质体释药行为的对比考察。中国医院药学杂志,2018年8月第38卷第16期
4. 艾伟拓,学术推广专题资料,伊立替康脂质体深度分析
